Química
Matéria é tudo aquilo que ocupa lugar no espaço e possui massa. Porém, cada matéria pode apresentar uma ou mais características (propriedades da matéria) que são diferentes de outra matéria, como também pode apresentar características semelhantes.
Quando misturamos óleo na água, ambos no estado líquido, percebemos rapidamente que um não se dissolve no outro e posiciona-se de forma diferente no recipiente.

Mistura formada por água e óleo
Essa simples mistura é suficiente para visualizarmos diversas propriedades da matéria, como a solubilidade (por não se dissolverem) e a densidade (por se posicionarem de forma diferente).
Mapa Mental: Matéria
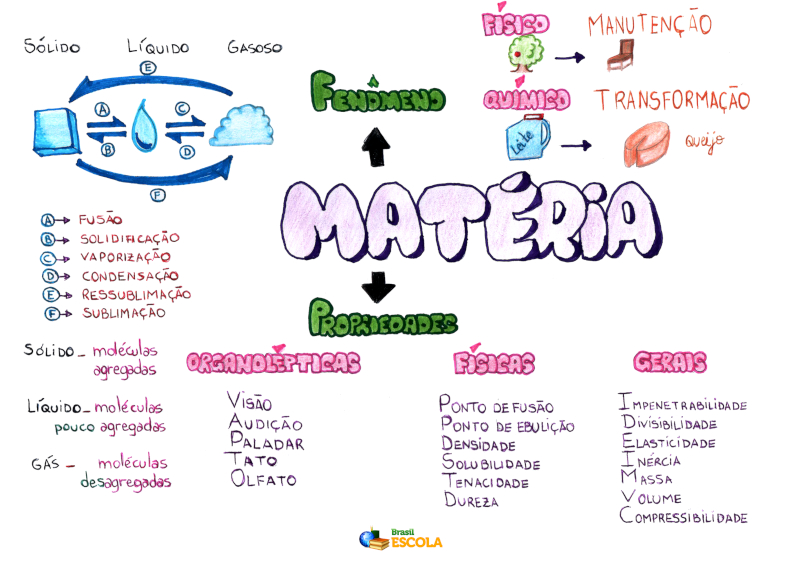
De uma forma geral, as propriedades da matéria estão divididas em dois grupos, as gerais e as específicas, todas exploradas a seguir:
Propriedades gerais da matéria
São as características que toda matéria apresenta, independentemente do seu estado físico (sólido, líquido ou gasoso).
- Inércia
Uma matéria sempre apresenta a tendência de manter o seu estado, seja de repouso, seja de movimento, a não ser que uma força externa influencie.
- Massa
Fisicamente, massa é uma grandeza que indica a medida da inércia ou da resistência de um corpo de ter seu movimento acelerado. Porém, podemos, de uma forma geral, associar a massa à quantidade de partículas existentes em uma matéria.
- Volume
É o espaço que uma matéria ocupa independentemente do seu estado físico.
- Impenetrabilidade
Duas matérias não podem ocupar o mesmo espaço ao mesmo tempo. Para enchermos uma garrafa com água, por exemplo, o ar tem que sair dela.
- Compressibilidade
É a característica que a matéria apresenta de diminuir o espaço que estava ocupando quando submetida a uma força externa. Isso pode ser visto quando tampamos a ponta de uma seringa e empurramos o gás em seu interior com o êmbolo.
- Elasticidade
É a característica que uma matéria tem de voltar à sua forma original quando uma força externa a estica ou comprime.
- Divisibilidade
É a capacidade que a matéria possui de ser dividida inúmeras vezes sem deixar de ser o que ela é, isto é, não há modificação de sua composição química.
Propriedades específicas da matéria
São características próprias de cada matéria, ou seja, se uma matéria apresenta, não quer dizer que outra também apresentará a mesma característica.
a) Propriedades organolépticas
É a característica que a matéria apresenta de estimular pelo menos um dos cinco sentidos. Veja alguns exemplos:
- Paladar: quando ingerimos cloreto de sódio, sentimos o sabor salgado;
- Audição: o som produzido pelo bife sendo frito em uma panela;
- Tato: quando passamos uma toalha no rosto e sentimos que ela é áspera;
- Visão: luz percebida a partir da explosão de fogos de artifício;
- Olfato: o aroma liberado quando descascamos uma mexerica.
b) Propriedades funcionais
É a característica que algumas substâncias apresentam de desempenhar um mesmo papel (função) ou promover uma mesma sensação. Veja alguns exemplos:
- Ácidos
Toda substância classificada como ácida apresenta sabor azedo (quando ingerida) e é capaz de sofrer o fenômeno da ionização (produzir íons).
- Bases
Toda substância classificada como básica promove a sensação de adstringência (sensação de secura e aperto na boca quando ingerida) e é capaz de sofrer o fenômeno da dissociação (liberar íons) em água.
- Sais
Toda substância classificada como salina possui sabor salgado (quando ingerida) e é capaz de sofrer o fenômeno da dissociação (liberar íons) em água.
c) Propriedades químicas
É a característica que uma matéria apresenta de se transformar em outra, em um processo denominado de fenômeno químico. Muitas vezes um fenômeno químico só ocorre quando a matéria é submetida a determinadas condições (temperatura, catalisadores, eletrólise etc.).
Uma matéria só se transforma em outra quando apresentam uma caraterística química em comum, principalmente átomos de elementos químicos em comum. Se queremos produzir iogurte, é preciso utilizar leite, e não suco de uva, por exemplo.
Outro exemplo clássico de fenômeno químico é a formação da água. Nesse processo, submetemos os gases oxigênio (O2) e hidrogênio (H2) a altas pressões e temperaturas, sendo o resultado a produção de uma substância completamente diferente, a água.
Isso não é possível quando reagimos os gases cloro (Cl2) e hidrogênio (H2). Nesse caso, o resultado é a formação de ácido clorídrico (HCl).
d) Propriedades físicas
São características da matéria determinadas de forma experimental.
- Solubilidade
É a característica que uma determinada matéria apresenta de dissolver outra. A água, por exemplo, tem a capacidade de dissolver o cloreto de sódio (sal de cozinha). Vale ressaltar que a quantidade de soluto, solvente e a temperatura são fatores que influenciam a solubilidade.
Um exemplo da influência da temperatura, quantidade de soluto e solvente está descrito na tabela a seguir:
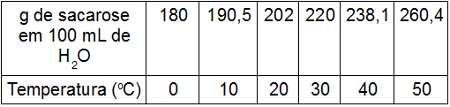
Tabela que expressa a solubilidade da sacarose em água
Na tabela, podemos observar que, se tivermos 100 mL de água, a 10oC, dissolveremos 190,5 g de sacarose. Agora, se essa mesma quantidade de água estiver a 50 oC, a quantidade de sacarose que poderá ser dissolvida é de 260,4 g.
- Densidade (d)
É a relação entre a massa (m) da matéria e o espaço (volume) que ela ocupa. Ela é calculada por meio da seguinte expressão:
d = m
V
V
- Ponto de fusão (PF)
É a temperatura que indica quando uma matéria deixa de ser sólida e passa a ser totalmente líquida. O ferro, por exemplo, deixa de ser sólido e passa a ser líquido a 1535 oC.
- Ponto de ebulição (PE)
É a temperatura que indica quando uma matéria deixa de ser líquida e passa a ser totalmente gasosa. O metal mercúrio, por exemplo, deixa de ser líquido e passa a ser gasoso a 356,9 oC.
- Tenacidade
É a capacidade que uma matéria tem de resistir ao impacto com outra matéria. Quando uma pedra é arremessada no vidro, este se quebra, ou seja, a pedra é mais tenaz que o vidro.
- Dureza
É a capacidade que uma matéria apresenta de riscar outra. Um exemplo é quando uma pedra arranha o vidro de uma janela, ou seja, a pedra é mais dura que o vidro.
Nenhum comentário:
Postar um comentário